Метод електронного балансу в доступному викладі
Суть методу електронного балансу полягає в:
-
підрахунку зміни ступеня окислення для кожного з елементів, що входять в рівняння хімічної реакції;
-
елементи, ступінь окислення яких в результаті реакції не змінюється - не беруться до уваги;
-
з інших елементів, ступінь окислення яких змінилася - складається баланс, що полягає в підрахунку кількості придбаних або втрачених електронів;
-
для всіх елементів, які втратили або отримали електрони (кількість яких відрізняється для кожного елемента) знаходиться найменше спільне кратне;
-
знайдене значення і є базовими коефіцієнтами для складання рівняння.
Візуально алгоритм вирішення задачі за допомогою методу електронного балансу представлений на діаграмі.
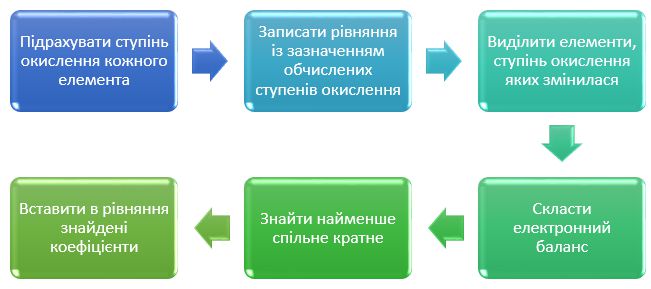
Як це виглядає на практиці, розглянуто на прикладі задач по кроках.
Завдання.
Методом електронного балансу підберіть коефіцієнти в схемах наступних окислювально-відновних реакцій за участю металів:
а) Ag + HNO
3 → AgNO
3 + NO + H
2O
б) Ca +H
2SO
4 → CaSO
4 + H
2S + H
2O
в) Be + HNO
3 → Be(NO
3)
2 + NO + H
2O
Рішення
Для вирішення даного завдання скористаємося
правилами визначення ступеня окислення.
Застосування методу електронного балансу по кроках. Приклад "а"
Складемо електронний баланс для кожного елемента реакції окислення Ag + HNO
3 → AgNO
3 + NO + H
2O.
Крок 1. Підрахуємо ступеня окислення для кожного елемента, що входить в хімічну реакцію.
Ag. Срібло спочатку нейтрально, тобто має ступінь окислення нуль.
Для
HNO3 визначимо ступінь окислення,
як суму ступенів окислення кожного з елементів.
Ступінь окислювання водню +1, кисню -2, отже, ступінь окислення азоту дорівнює:
0 - (+1) - (-2)*3 = +5
(в сумі, знову ж таки, отримаємо нуль, як і повинно бути)
Тепер перейдемо до другої частини рівняння.
Для
AgNO3 ступінь окислення срібла +1 кисню -2, отже ступінь окислення азоту дорівнює:
0 - (+1) - (-2)*3 = +5
Для
NO ступінь окислення кисню -2, отже азоту +2
Для
H2O ступінь окислення водню +1, кисню -2
Крок 2. Запишемо рівняння в новому вигляді, із зазначенням ступеня окислення кожного з елементів, що беруть участь в хімічній реакції.
Ag
0 + H
+1N
+5O
-23 → Ag
+1N
+5O
-23 + N
+2O
-2 + H
+12O
-2
З отриманого рівняння з зазначеними ступенями окислення, ми
бачимо незбалансованість за сумою позитивних і негативних ступенів окислення
окремих елементів.
Крок 3. Запишемо їх окремо у вигляді електронного балансу - який елемент і скільки втрачає або набуває електронів:
(Необхідно взяти до уваги, що елементи, ступінь окислення яких не змінилася - в даному розрахунку не беруть участь)
Ag
0 - 1e = Ag
+1
N
+5 +3e = N
+2
Срібло втрачає один електрон, азот набуває три. Таким чином, ми бачимо, що для балансування потрібно застосувати коефіцієнт 3 для срібла і 1 для азоту. Тоді число втрачаються і придбаних електронів зрівняється.
Крок 4. Тепер на підставі отриманого коефіцієнта "3" для срібла, починаємо балансувати все рівняння з урахуванням кількості атомів, що беруть участь в хімічній реакції.
- У первісному рівнянні перед Ag ставимо трійку, що потребують такого ж коефіцієнта перед AgNO3
- Тепер у нас виник дисбаланс за кількістю атомів азоту. У правій частині їх чотири, в лівій - один. Тому ставимо перед HNO3 коефіцієнт 4
- Тепер залишається зрівняти 4 атома водню зліва і два - праворуч. Вирішуємо це шляхом застосування коеффііента 2 перед H2O
Відповідь:
3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O
Приклад "б"
Складемо електронний баланс для кожного елемента реакції окислення Ca +H
2SO
4 → CaSO
4 + H
2S + H
2O
Для H
2SO
4 ступінь окислення водню +1 кисню -2 звідки ступінь окислення сірки 0 - (+1)*2 - (-2)*4 = +6
Для CaSO
4 ступінь окислення кальцію дорівнює +2 кисню -2 звідки ступінь окислення сірки 0 - (+2) - (-2)*4 = +6
Для H
2S ступінь окислення водню +1, відповідно сірки -2
Ca
0 +H
+12S
+6O
-24 → Ca
+2S
+6O
-24 + H
+12S
-2 + H
+12O
-2
Ca
0 - 2e = Ca
+2 (коеффііент 4)
S
+6 + 8e = S
-2
Відповідь:
4Ca + 5H2SO4 = 4CaSO4 + H2S + 4H2O
Приклад "в"
Складемо електронний баланс для кожного елемента реакції окислення Be + HNO
3 → Be(NO
3)
2 + NO + H
2O
HNO
3 див. вище
Для Be(NO
3)
2 ступінь окислення берилію +2, кисню -2, звідки ступінь окислення азоту ( 0 - (+2) - (-2)*3*2 ) / 2 = +5
NO див. вище
H
2O див. вище
Be
0 + H
+1N
+5O
-23 → Be
+2(N
+5O
-23)
2 + N
+2O
-2 + H
+12O
-2
Be
0 - 2e = Be
+2 (коеффііент 3)
N
+5 +3e = N
+2 (коеффііент 2)
Відповідь:
3Be + 8HNO3 → 3Be(NO3)2 + 2NO + 4H2O

